PENELITIAN TENTANG PROPOELIX TERHADAP DBD

PENDAHULUAN
 Sejak tahun 1994, Demam Berdarah Dengue (DBD) telah menyebar ke seluruh provinsi yang ada di Indonesia. Saat ini, DBD sudah endemis di banyak kota besar. Sejak 1975, penyakit ini telah berjangkit di daerah pedesaan. Mengingat obat dan vaksin untuk DBD sampai saat ini belum tersedia maka upaya pemberantasan penyakit dititik beratkan pada pemberantasan vektor secara intensif dan terapi suportif. Berbagai penelitian dari bahan-bahan alami di Indonesia telah dilakukan sebagai terapi suportif, dengan hasil yang belum begitu memuaskan. Belum ada upaya intervensi terhadap reaksi yang terjadi pada tubuh pasien infeksi dengue dan faktor yang berperan, sehingga diperlukan upaya baru dalam terapi atau penatalaksaan yang efektif untuk menghambat pathogenesis dan progresivitas DBD.
Sejak tahun 1994, Demam Berdarah Dengue (DBD) telah menyebar ke seluruh provinsi yang ada di Indonesia. Saat ini, DBD sudah endemis di banyak kota besar. Sejak 1975, penyakit ini telah berjangkit di daerah pedesaan. Mengingat obat dan vaksin untuk DBD sampai saat ini belum tersedia maka upaya pemberantasan penyakit dititik beratkan pada pemberantasan vektor secara intensif dan terapi suportif. Berbagai penelitian dari bahan-bahan alami di Indonesia telah dilakukan sebagai terapi suportif, dengan hasil yang belum begitu memuaskan. Belum ada upaya intervensi terhadap reaksi yang terjadi pada tubuh pasien infeksi dengue dan faktor yang berperan, sehingga diperlukan upaya baru dalam terapi atau penatalaksaan yang efektif untuk menghambat pathogenesis dan progresivitas DBD.
Propolis, suatu senyawa yang diperoleh dari aktivitas lebah telah lama diketahui mempunyai efek antioksidan, antiinflamasi, antiviral, antimitogenik, antikarsinogen, dan efek imunomodulator, sehingga diduga dapat berperan dalam terapi suportif DBD.
Sampai saat ini, di Indonesia belum ada penelitian mengenai efek pemberian propolis sebagai terapi suportif DBD yang sudah dipublikasikan. Dengan penelitian ini diharapkan mampu memberikan sumbangan pengetahuan dan penanganan terhadap pasien demam berdarah dengan lebih baik dengan memanfaatkan sumber potensi yang ada di Indonesia.
Penelitian ini bertujuan mengetahui apakah propolis ekstrak dapat digunakan sebagai terapi tambahan pada penderita DBD. Penelitian ini juga bertujuan mengetahui apakah terdapat perbedaan dalam perbaikan nilai trombosit, leukosit, dan hematrokit antara penderita DBD yang mendapat propolis ekstrak dibandingkan mereka yang hanya mendapat terapi standar untuk DBD.
Penelitian diharapkan dapat bermanfaat dalam membantu pasien penderita DBD mengurangi gejala klinis dan menurunkan lama perawatan bagi pasien DBD di rumah sakit. Juga untuk membantu menetapkan SOP terapi terhadap penatalaksanaan pasien DBD di Rumah Sakit Persahabatan.
Demam dengue dan demam berdarah dengue (DBD) disebabkan oleh virus dengue, yang termasuk dalam genus flavavirus, keluarga flaviviridae. Flavavirus merupakan virus dengan diameter 30nm, terdiri dari asam ribonukleat rantai tunggal dengan berat molekul 4x106. Terdapat 4 serotipe, yaitu DEN-1, 2, 3 dan 4, yang semuanya dapat menyebabkan demam dengue maupun DBD. Keempat serotype ditemukan di Indonesia dengan DEN-3 yang terbanyak. Demam dengue menimbulkan manifestasi klinis yang ringan, sedang DBD dapat menyebabkan gejala yang berat sampai Dengue Shock Syndrome (DSS). Berbagai kelainan hematologis menyertai perjalanan penyakit DBD sehingga keadaan ini dipakai untuk penunjang diagnosis dan parameter perbaikan klinis. Pathogenesis terjadinya DBD hingga saat ini masih diperdebatkan, terdapat bukti yang kuat bahwa mekanisme imunopatologis berperan kuat. Infeksi virus dengue menyebabkan aktivasi makrofag yang memfagositosis kompleks virus-antibodi. Pada DBD terjadi penurunan kadar komplomen, semakin berat gejala, semakin besar pula penurunan kadar komplomen seperti C proaktivator. Secara radioaktif dibuktikan bahwa penurunan bukan karena produksi yang menurun atau ekstravasasi.
Propolis adalah nama lain dari lem lebah, propolis balsam, propolis resin, propolis wax, bee glue, atau hive dross. Propolis merupakan produk dari lebah madu (Apis melifera) yang dikumpulkan dari pucuk daun-daun yang muda atau bersumber dari getah berbau manis dari pepohonan yang dikumpulkan lebah lalu dikunyah, kemudian dicampur dengan enzim tertentu dari dalam tubuhnya dan disimpan dalam keranjang serbuk yang ada pada kaki belakang. Propolis digunakan untuk menambal dan mensterilkan sarang dan sudah dikenal sebagai pengobatan sejak berabad-abad yang lalu. Nama propolis berasal dari bahasa Yunani (pro=sebelum, polis=kota). Hal ini menggambarkan bahwa lebah madu sebelum membuat sarangnya pertama kali akan membangun dinding sebagai pintu masuk pertama yang juga antimicrobial yang dapat mencemari koloninya. Sifat desinfektan alami yang terkandung di dalamnya sangat ampuh dalam membunuh kuman, terbukti dengan ditemukannya seekor tikus dalam sarang lebah yang telah mati selama kurang lebih 5 tahun dalam keadaan tidak membusuk.
Komposisi kimia dari propolis sampai saat ini masih belum sepenuhnya diketahui. Berupa resin yang biasanya berwarna kehijauan atau coklat, dengan rasa poplar buds, madu, lilin, atau vanilla, dapat juga pahit. Komposisi kimia, warna, dan rasa tergantung kondisi geografis setempat. Bentuknya padat dan brittle jika dalam keadaan dingin, sangat sticky jika hangat. Kaczmarek, dkk., (1983) menemukan kandungan b- Amylase dalam propolis, sedangkan Bankova dkk., (1982. 1982 & 1988) menemukan bahwa kandungan utama propolis adalah komponen polyphenolic, flavones, flavonones, phenolic acid, dan golongan ester. Polyakof dkk., (1998) meneliti adanya fatty acid dalam propolis. Hegazi dan Abd el Hady (1997) menganalisis Egyptian propolis dengan gas chromatography mass spectrometry dan mendapatkan kandungan phenolic acid esters (72,7%); phenolic acids (2,4%); dihydrochalcones (6,5%); chalcones (1,7%); flavavones (1,9%); flavones (4,6%); dan tetrahydrofuran derivate (0,7%). Nikolaev (1978) menemukan mineral seperti Mg, Ca, l, K, Na, Cu, Zn, Mn, Fe, serta vitamin B1, B2, B6, C, E, fatty acid.
Komposisi propolis sangat bervariasi, bergantung dari jenis tanaman yang didatangi lebah. Kandungan yang sudah diidentifikasi antara lain: 50-55% getah dan balsam, 30% getah lebah, 10-15% minyak alami, 5% serbuk lebah, dan bioflavonoid.
Propolis mengandung zat-zat yang dibutuhkan untuk membangun kekebalan tubuh dan mengaktifkan kelenjar thymus. Dapat disimpulkan dari berbagai penelitian bahwa zat-zat tersebut adalah: propolis mengandung semua vitamin kecuali vitamin K; propolis mengandung semua mineral yang dibutuhkan tubuh kecuali sulfur; propolis mengandung 16 rantai asam amino esensial yang dibutuhkan untuk regenerasi sel; propolis mengandung bioflavanoid, yaitu zat antioksidan sebagai suplemen sel. Menurut penelitian, kandungan bioflavanoid pada satu tetes propolis setara dengan bioflavanoid yang dihasilkan dari 500 buah jeruk.
 Propolis telah digunakan sejak 300 SM untuk kosmetik. Kemudian digunakan sebagai antiinflamasi, pengobatan luka, antibakteri, antiviral, fungisidal, anestesi lokal, anti ulser, immunostimulan, dan kemampuan sebagai agen sitostatik. Propolis juga diketahui mempunyai efek antimikroba, antijamur, antiviral, antiinflamasi, antioksidan, absorpsi nutrisi, penyembuhan luka, dan meningkatkan daya tahan tubuh. Berbagai penelitian telah dilakukan untuk menilai manfaat pemberian propolis sebagai antiinflamasi. Efek ethanolic ekstrak propolis (EEP) terhadap inflamasi kronis telah dibuktikan pada penelitian tikus yang menderita arthritis. Dalam penelitian tersebut, arthritis indeks dapat ditekan dengan pemberian EEP 50-100 mg/kgBB/hari. Efek analgesic propolis sebanding dengan prednisolone (2,5 mg/kg/hari P.O.) dan acetylsalicylic acid (100 mg/kg/hari). Juga dibuktikan bahwa propolis mempunyai efek antiinflamasi akut maupun kronik (Park and Kahng, 1999), terutama peran dari aktivitas Caffeic Acid phenethyl Ester (CAPE) yang dikandung propolis.
Propolis telah digunakan sejak 300 SM untuk kosmetik. Kemudian digunakan sebagai antiinflamasi, pengobatan luka, antibakteri, antiviral, fungisidal, anestesi lokal, anti ulser, immunostimulan, dan kemampuan sebagai agen sitostatik. Propolis juga diketahui mempunyai efek antimikroba, antijamur, antiviral, antiinflamasi, antioksidan, absorpsi nutrisi, penyembuhan luka, dan meningkatkan daya tahan tubuh. Berbagai penelitian telah dilakukan untuk menilai manfaat pemberian propolis sebagai antiinflamasi. Efek ethanolic ekstrak propolis (EEP) terhadap inflamasi kronis telah dibuktikan pada penelitian tikus yang menderita arthritis. Dalam penelitian tersebut, arthritis indeks dapat ditekan dengan pemberian EEP 50-100 mg/kgBB/hari. Efek analgesic propolis sebanding dengan prednisolone (2,5 mg/kg/hari P.O.) dan acetylsalicylic acid (100 mg/kg/hari). Juga dibuktikan bahwa propolis mempunyai efek antiinflamasi akut maupun kronik (Park and Kahng, 1999), terutama peran dari aktivitas Caffeic Acid phenethyl Ester (CAPE) yang dikandung propolis.
Propolis dengan berbagai manfaat dapat meningkatkan aktivasi dari makrofag (Sforcin, 2007), di mana propolis dapat menstimulasi produksi sitokinin seperti IL-1B dan TNF-a pada mencit (Moriyasu et al., 1994). Kandungan dari ekstrak propolis yaitu CAPE (Caffeic Acid Phenethyl Ester) memiliki aktivasi antiinflamasi dengan menghambat pelepasan asam arakidonat dari membrane sel, menekan aktivitas enzim COX-1 dan COX-2 (Borelli, 2002). Kemudian CAPE (1,5 dan 10 uM) memiliki efek menghambat transkripsi dari faktor NF-kB dan NFAT dari sel T pada proses inflamasi.
Propolis ekstrak (Propoelix) yang dipatenkan telah diuji oleh Laboratorium Brunswick, Amerika Serikat, pada 13 Januari 2012, mengandung Oxygen Radical Absorbance Capacity (ORAC), dengan pengukuran aktivitas antioksidan sebesar 21.921 dibandingkan dengan buah jeruk yang hanya memiliki nilai ORAC sebesar 24.
Pengobatan demam dengue dewasa ini hanya sebatas terapi suportif. Oleh sebab itu, propolis diharapkan dapat menjadi salah satu bentuk pilihan terapi suportif pada pasien dengan diagnosis demam dengue. Mekanisme kerja propolis yang dapat menekan inflamasi dan meningkatkan aktivitas makrofag dianggap mampu meningkatkan imunitas dan memperbaiki permeabilitas kapiler akibat penyakit demam dengue.
Pada skema 1 ditunjukkan hubungan skematik proses inflamasi yang terjadi pada DBD dan peran CAPE dalam menghambat proses tersebut.
MATERI DAN METODE
Penelitian ini merupakan uji klinis dengan desain randomized controlled trial yang dikerjakan di SMF Penyakit Dalam RS Persahabatan, Jakarta, selama empat bulan, mulai Desember 2009 sampai Maret 2010. Materi penelitian adalah HDI Propoelix kapsul 100 mg.
Tabel 1: Karakteristik dasar kedua kelompok pengobatan
 Kriteria inklusi: usia diatas 15 tahun, penderita Demam Berdarah Dengue, demam kurang dari atau sama dengan 72 jam, dapat makan dan minum (compos mentis), trombosit kurang dari 100.000/uL, dan bersedia ikut dalam penelitian. Sedangkan kriteria eksklusi: menderita penyakit serius ataupun penyakit kronik lainnya, penderita DBD memiliki penyakit kelainan jiwa, alergi terhadap propolis, sedang hamil dan menyusui, subyek penelitian mendapatkan transfuse darah/trombosit konsentrat, mengonsumsi obat-obatan selain rekomendasi dokter.
Kriteria inklusi: usia diatas 15 tahun, penderita Demam Berdarah Dengue, demam kurang dari atau sama dengan 72 jam, dapat makan dan minum (compos mentis), trombosit kurang dari 100.000/uL, dan bersedia ikut dalam penelitian. Sedangkan kriteria eksklusi: menderita penyakit serius ataupun penyakit kronik lainnya, penderita DBD memiliki penyakit kelainan jiwa, alergi terhadap propolis, sedang hamil dan menyusui, subyek penelitian mendapatkan transfuse darah/trombosit konsentrat, mengonsumsi obat-obatan selain rekomendasi dokter.
Uji klinis dalam penelitian ini bertujuan mengetahui keefektifan propoelix, propolis ekstrak yang digunakan sebagai terapi tambahan penanganan DBD di samping terapi standar yang berlaku di rumah sakit. Keefektifan dinilai dari adanya perbedaan perubahan parameter klinis, laboratorium, dan lama perawatan antara kedua kelompok penelitian. Dengan kata lain, ada perbedaan perubahan antara kedua kelompok disebabkan oleh pengaruh propoelix.
Variable bebas: pemberian terapi tambahan propoelix. Variable terikat: laboratorium (hemoglobin, hematrokit, lekosit dan trombosit), suhu dan lama perawatan di rumah sakit. Parameter laboratorium meliputi pemeriksaan hemoglobin, hematokrit, lekosit, dan trombosit. Kondisi klinis adalah pengukuran terhadap suhu tubuh pasien. Lama perawatan adalah jumlah hari pasien menjalani perawatan di rumah sakit.
Langkah penelitian dimulai dengan membuat status setiap subjek penelitian. Kemudian, pasien yang memenuhi kriteria dibagi menjadi dua kelompok secara randomisasi: kelompok I sebagai kontrol mendapat placebo; kelompok II mendapat propoelix kapsul (100mg). pasien diikuti selama 4 hari, dilakukan pemeriksaan serial hematologi rutin, serologis untuk DBD dan pengamatan klinis. Lama penelitian empat bulan, dengan jumlah subjek penelitian setiap kelompok sebanyak 30-50 pasien. Data dan perhitungan statistic diolah dengan uji t tidak berpasangan atau uji Mann Whitney untuk membandingkan efek pengobatan terhadap berbagai parameter klinis dan laboratories dengan mata numeric. Uji repeat Anova atau uji Friedman untuk membandingkan perubahan parameter tiap kelompok setiap harinya, dilanjutkan analisis post hoc. Uji Chi Square untuk membandingkan data kategorik kedua kelompok. Sebagai batas kemaknaan diambil nilai < 0,05.
HASIL
Didapatkan 114 subjek yang memenuhi kriteria inklusi dan eksklusi, 13 subjek dikeluarkan (dieksklusi) dari penelitian karena mengonsumsi obat di luar standar/herbal tanpa sepengetahuan dokter, 5 dieksklusi karena terdapat infeksi komorbid, dan 3 orang lagi karena tidak mau melanjutkan penelitian. Data dasar kedua kelompok disajikan dapat dilihat pada tabel 1.
Perbandingan karakteristik demografi menunjukkan tidak terdapat perbedaan bermakna antara kedua kelompok sebelum diberikan pengobatan untuk karakteristik proporsi jenis kelamin, dengan menggunakan uji chi kuadrat (p=0,205). Dengan uji t tidak berpasangan atau Mann Whitney pada variable numeric tidak terdapat perbedaan bermakna antara kedua kelompok sebelum diberikan pengobatan, meliputi karakteristik umur (p=0,817), tinggi badan (p=0,199), tekanan darah diastolic (p=0,628), dan tekanan darah diastolic (p=671). Berat badan terdapat perbedaan bermakna (p=0,024).
Tabel 1 menggambarkan bahwa karakteristik demografi antara kelompok placebo (n=46) dan kelompok propoelix (n=47) relative setara atau dari variable demografi tidak ada perbedaan yang bermakna. Proses randomisasi membagi kedua kelompok secara demografi berjalan dengan baik.
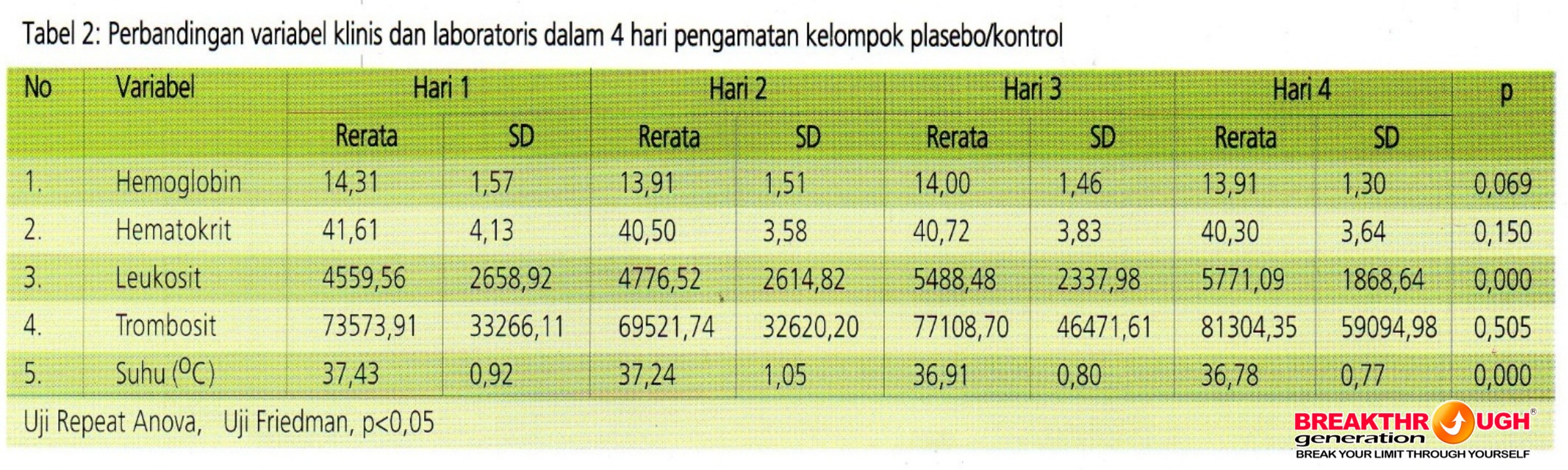
Tabel 2 menggambarkan hasil uji menggunakan repeat Anova atau uji Friedman untuk membandingkan variable selama pengamatan. Sedikitnya terdapat dua perbedaan kadar lekosit dan suhu pada kelompok control (placebo) pada pengukuran hari ke-1, 2, 3, dan 4. Selanjutnya dilakukan uji post hoc untuk mengetahui dua pengukuran mana yang berbeda sebagai berikut: kadar lekosit terdapat perbedaan antara hari ke-1 dengan ke-3 (p=0,002); hari ke-1 dengan ke-4 (p=0,001); hari ke-2 dengam ke-3 (p=0,005); dan hari ke-2 dengan ke-4 (p=0,004). Suhu pasien terdapat perbedaan antar hari ke-1 dengan ke-3 (p=0,000); hari ke-1 dengan ke-4 (p=0,000); hari ke-2 dengan ke-3 (p=0,004); dan hari ke-2 dengan ke-4 (p=0,000).
Sedangkan pengamatan untuk kadar hemoglobin (p=0,069); hematokrit (p=0,150); dan trombosit (p=0,505) selama empat hari menunjukkan tidak adanya perbedaan yang bermakna secara statistic pada kelompok placebo.
Tabel 3: Perbandingan variabel klinis dan laboratoris dalam 4 hari pengamatan kelompok eksperimen/propolix
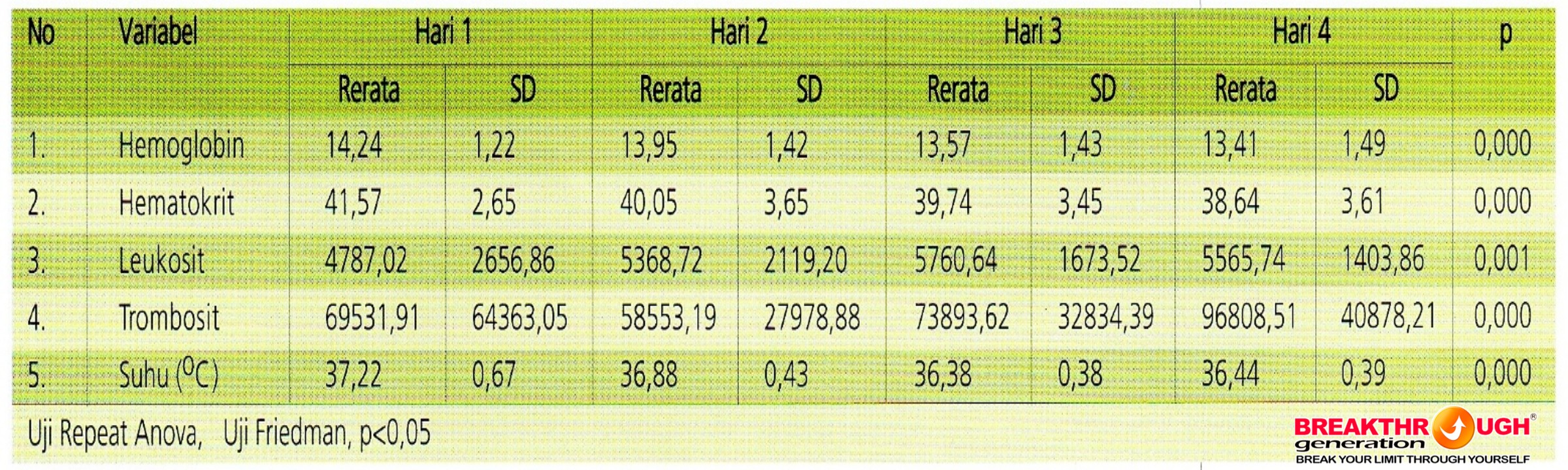
Tabel 3 menunjukkan sdikitnya terdapat dua perbedaan yang bermakna secara statistik pada kadar hemoglobin, hematokrit, lekosit, trombosit, dan suhu pada kelompok eksperimen (propoelix 100 mg) pengukuran hari ke-1, 2, 3, dan 4. Selanjutnya dilakukan uji pos hoc untuk mengetahui pengukuran mana yang berbeda sebagai berikut:
- Untuk kadar Hb terdapat perbedaan antara hari ke-1 dengan ke-2 (p=0,003); hari ke-1 dengan ke-3 (p=0,000); hari ke-1 dengan ke-4 (p=0,000); dan hari ke-2 dengan ke-4 (p=0,000).
- Kadar Ht terdapat perbedaan antara hari ke-1 dengan ke-2 (p=0,011); hari ke-1 dengan ke-3 (p=0,000); hari ke-1 dengan ke-4 (p=0,000); dan hari ke-2 dengan ke-4 (p=000).
- Kadar lekosit terdapat perbedaan antara hari ke-1 dengan ke-3 (p=0,003); hari ke-1 dengan hari ke-4 (p=0,016).
- Kadar trombosit terdapat perbedaan antara hari ke-1 dengan ke-3 (p=0,000); hari ke-1 dengan ke-4 (p=0,000); hari ke-2 dengan ke-3 (p=0,000); hari ke-2 dengan ke-4 (p=0,000).
- Suhu pasien terdapat perd=bedaan antara hari ke-1 dengan ke-2 (p=0,000); hari ke-1 dengan ke-3 p=0,000); hari ke-1 dengan ke-4 (p=0,000); hari ke-2 dengan ke-3 (p=0,000); hari ke-2 dengan ke-4 (p=0,000); dan hari ke-3 dengan ke-4 (p=0,002).
Semua variabel laboratorium dan klinis yang dilakukan pengukuran selama empat hari pada kelompok propoelix menunjukkan perubahan yang signifikan secara statistic pada semua variabel pengamatan dibandingkan kelompok control yang hanya variabel lekosit dan suhu.
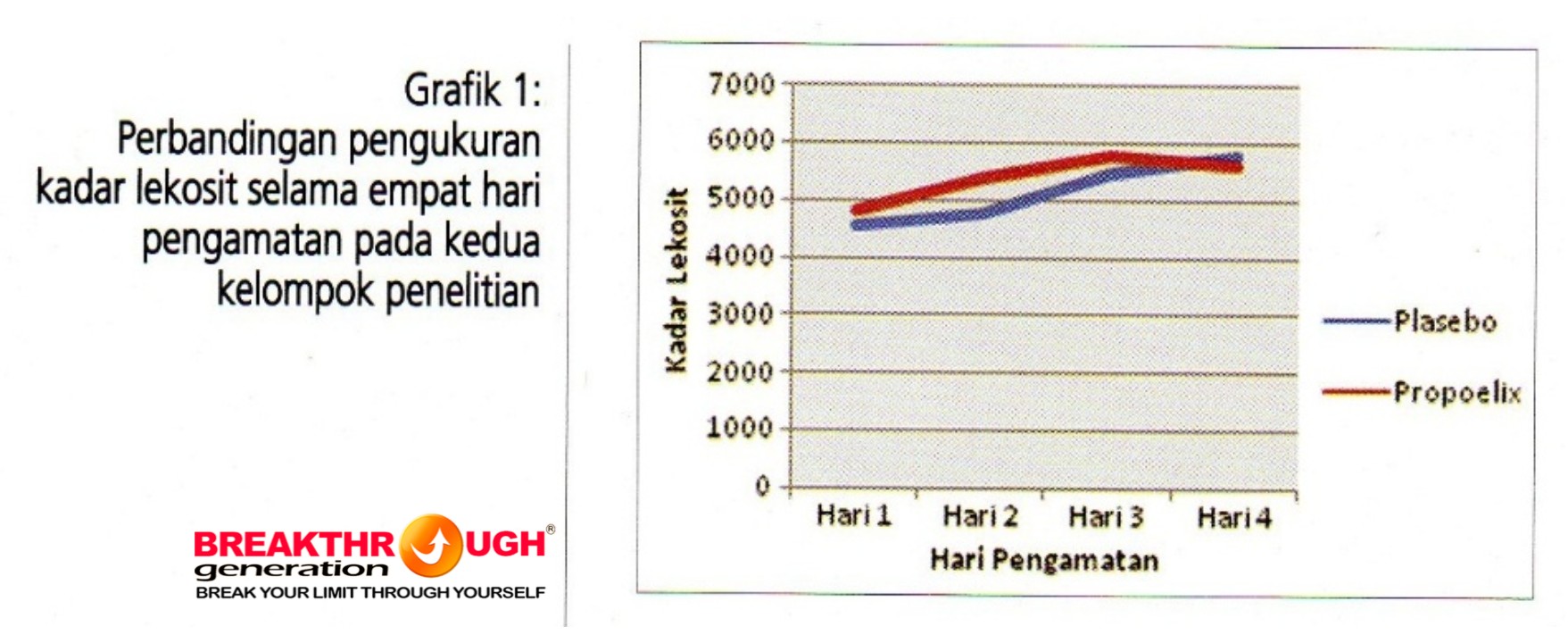
Grafik 1 menggambarkan pengamatan terhadap kadar leukosit pada kedua kelompok di awali dengan kadar lekosit yang lebih rendah dari normal (5000-10000) atau lekopenia ringan yang sering terjadi pada DBD, mulai meningkat pada hari kedua sudah mendekati kadar normal. Todak ada perbedaan yang bermakna antara kedua kelompok pada tiap pengukurannya. Kelompok eksperimen cenderung tetap setelah kadar lekosit dalam batas normal.
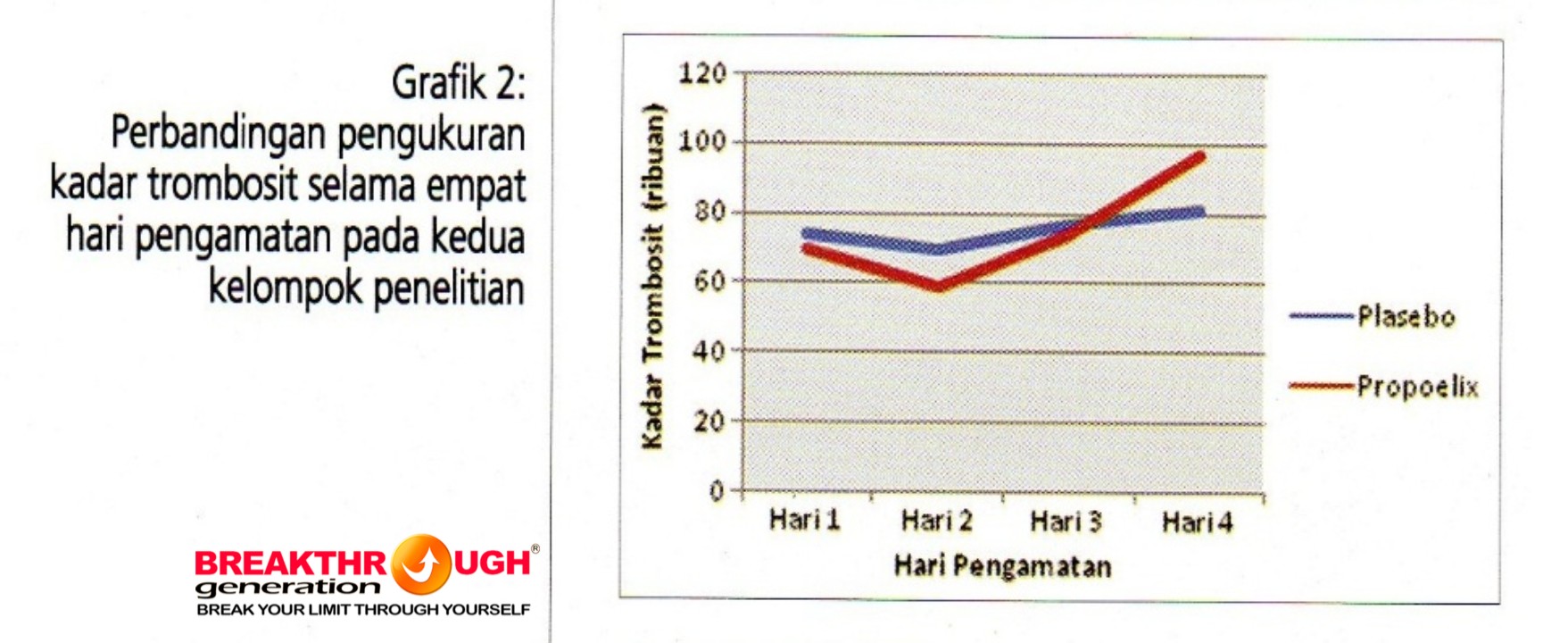 Grafik 2 menggambarkan perbandingan kadar trombosit kedua kelompok pada hari pertama menunjukkan rerata setara, sampai pengukuran hari ke-2 dan ke-3 tidak terdapat perbedaan bermakna. Namun, perubahan kadar trombosit dari baseline kedua kelompok berbeda pada pengukuran hari keempat, di mana kelompok propoelix kadar trombosit lebih cepat terjadi peningkatan disbanding kelompok placebo.
Grafik 2 menggambarkan perbandingan kadar trombosit kedua kelompok pada hari pertama menunjukkan rerata setara, sampai pengukuran hari ke-2 dan ke-3 tidak terdapat perbedaan bermakna. Namun, perubahan kadar trombosit dari baseline kedua kelompok berbeda pada pengukuran hari keempat, di mana kelompok propoelix kadar trombosit lebih cepat terjadi peningkatan disbanding kelompok placebo.
 Grafik 3 menunjukkan perbandingan suhu tubuh kedua kelompok pada hari pertama menunjukkan rerata yang tidak berbeda bermakna. Sedangkan pada pengamatan hari berikutnya terdapat perbedaan bermakana pada pengukuran hari ke-2, 3, dan 4. Pengamatan hari keempat suhu tubuh masih menunjukkan kecenderungan untuk turun. Kelompok propoelix menunjukkan terjadi penurunan suhu yang lebih cepat setelah mendapatkan pengobatan tambahan propoelix disbanding kelompok placebo.
Grafik 3 menunjukkan perbandingan suhu tubuh kedua kelompok pada hari pertama menunjukkan rerata yang tidak berbeda bermakna. Sedangkan pada pengamatan hari berikutnya terdapat perbedaan bermakana pada pengukuran hari ke-2, 3, dan 4. Pengamatan hari keempat suhu tubuh masih menunjukkan kecenderungan untuk turun. Kelompok propoelix menunjukkan terjadi penurunan suhu yang lebih cepat setelah mendapatkan pengobatan tambahan propoelix disbanding kelompok placebo.

Tabel 4 menunjukkan tidak ada perbedaan klinis dan laboratories dalam hal kadar Hb, Ht, leukosit, trombosit, dan suhu pada hari pertama perawatan pada kelompok control dan kelompok yang mendapat propoelix. Ini menunjukkan kondisi awal kedua kelompok adalah setara dari variabel yang akan diukur.
 Tabel 5 menunjukkan tidak ada perbedaan kadar Hb , Ht, leukosit, trombosit pada hari kedua pada kedua kelompok penelitian. Terdapat perbedaan bermakna suhu badan pada hari kedua antara kedua kelompok. Kelompok eksperimen lebih rendah dibandingkan placebo pada pengukuran hari kedua (p=0,036). Hal ini menunjukkan rerata pengukuran suhu tubuh pada hari kedua, kelompok propoelix mengalami penurunan yang lebih cepat dibandingkan kelompok placebo.
Tabel 5 menunjukkan tidak ada perbedaan kadar Hb , Ht, leukosit, trombosit pada hari kedua pada kedua kelompok penelitian. Terdapat perbedaan bermakna suhu badan pada hari kedua antara kedua kelompok. Kelompok eksperimen lebih rendah dibandingkan placebo pada pengukuran hari kedua (p=0,036). Hal ini menunjukkan rerata pengukuran suhu tubuh pada hari kedua, kelompok propoelix mengalami penurunan yang lebih cepat dibandingkan kelompok placebo.
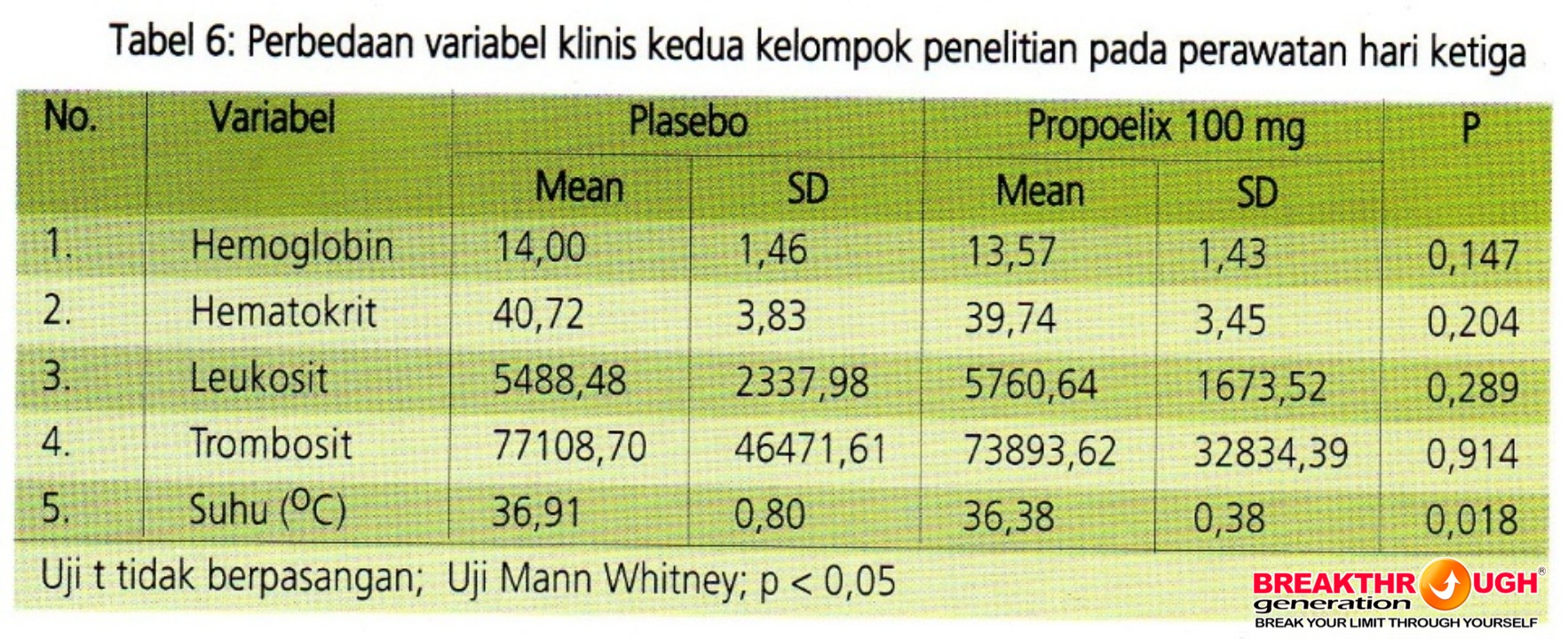 Tabel 6 menunjukkan tidak ada perbedaan kadar Hb, Ht, leukosit, dan trombosit pada hari ketiga pada kedua kelompok penelitian. Terdapat perbedaan yang bermakna suhu badan pada hari kedua antara kedua kelompok. Kelompok eksperimen rerata suhunya lebih rendah dibandingkan kelompok placebo. Hal ini menunjukkan rerata pengukuran suhu tubuh hari ketiga (p=0,018) kelompok propoelix mengalami penurunan yang lebih cepat dibandingkan kelompok placebo.
Tabel 6 menunjukkan tidak ada perbedaan kadar Hb, Ht, leukosit, dan trombosit pada hari ketiga pada kedua kelompok penelitian. Terdapat perbedaan yang bermakna suhu badan pada hari kedua antara kedua kelompok. Kelompok eksperimen rerata suhunya lebih rendah dibandingkan kelompok placebo. Hal ini menunjukkan rerata pengukuran suhu tubuh hari ketiga (p=0,018) kelompok propoelix mengalami penurunan yang lebih cepat dibandingkan kelompok placebo.
 Tabel 7 menggambarkan tidak ada perbedaan kadar hemoglobin, hematokrit dan leukosit pada hari keempat pada kedua kelompok penelitian. Terdapat perbedaan yang bermakna kadar trombosit dan suhu badan pada hari ke-4 antara kedua kelompok. Kadar trombosit kelompok eksperimen lebih meningkat dibandingkan kelompok control (p=0,030). Suhu pada hari ke-4 kelompok eksperimen tetap lebih rendah dibandingkan placebo (p=0,009).
Tabel 7 menggambarkan tidak ada perbedaan kadar hemoglobin, hematokrit dan leukosit pada hari keempat pada kedua kelompok penelitian. Terdapat perbedaan yang bermakna kadar trombosit dan suhu badan pada hari ke-4 antara kedua kelompok. Kadar trombosit kelompok eksperimen lebih meningkat dibandingkan kelompok control (p=0,030). Suhu pada hari ke-4 kelompok eksperimen tetap lebih rendah dibandingkan placebo (p=0,009).
 Tabel 8 menunjukkan terdapat perbedaan bermakna lama hari perawatan antara kelompok placebo dan kelompok propoelix (p=0,002). Dari nilai minimum dan maksimum hari perawatan juga menunjukkan kelompok placebo dirawat lebih lama hari perawatannya di rumah sakit. Secara klinis menunjukkan propoelix efektif menurunkan lama hari perawatan di rumah sakit. Dengan kata lain, dengan penambahan propoelix sebagai terapi tambahan mempersingkat lama perawatan pasien DBD di rumah sakit.
Tabel 8 menunjukkan terdapat perbedaan bermakna lama hari perawatan antara kelompok placebo dan kelompok propoelix (p=0,002). Dari nilai minimum dan maksimum hari perawatan juga menunjukkan kelompok placebo dirawat lebih lama hari perawatannya di rumah sakit. Secara klinis menunjukkan propoelix efektif menurunkan lama hari perawatan di rumah sakit. Dengan kata lain, dengan penambahan propoelix sebagai terapi tambahan mempersingkat lama perawatan pasien DBD di rumah sakit.
 Grafik 4 menggambarkan adanya perbedaan, tetapi secara stastitik tidak bermakna. Ada perbedaan perubahan dari hari 1 (baseline) kadar Hb pada perubahan hari ke-1, 2, dan 3 antara kelompok control dan eksperimen. Artinya, kadar Hb kedua kelompok perlakuan setara dan kemungkinan kadar Hb tidak dipengaruhi oleh propoelix.
Grafik 4 menggambarkan adanya perbedaan, tetapi secara stastitik tidak bermakna. Ada perbedaan perubahan dari hari 1 (baseline) kadar Hb pada perubahan hari ke-1, 2, dan 3 antara kelompok control dan eksperimen. Artinya, kadar Hb kedua kelompok perlakuan setara dan kemungkinan kadar Hb tidak dipengaruhi oleh propoelix.
 Grafik 5 menggambarkan tidak ada perbedaan dari hari ke-1 (baseline) kadar hematokrit pada perubahan hari ke-1 dan ke-3 antara kelompok control dan eksperimen. Sedangkan perubahan hematokrit secara statistic berbeda bermakna pada perubahan hari ke-2 di mana kelompok propoelix terjadi penurunan hematokrit yang lebih besar.
Grafik 5 menggambarkan tidak ada perbedaan dari hari ke-1 (baseline) kadar hematokrit pada perubahan hari ke-1 dan ke-3 antara kelompok control dan eksperimen. Sedangkan perubahan hematokrit secara statistic berbeda bermakna pada perubahan hari ke-2 di mana kelompok propoelix terjadi penurunan hematokrit yang lebih besar.
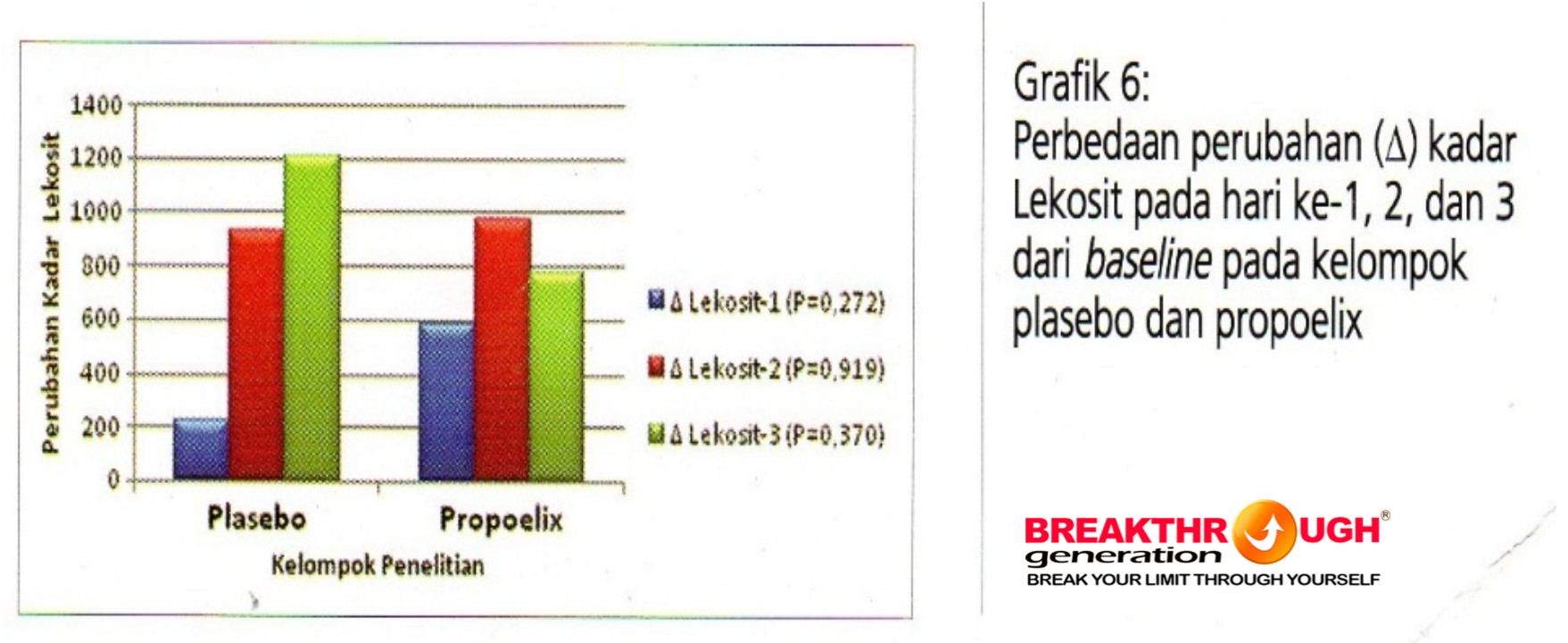 Grafik 6 menggambarkan tidak ada perbedaan yang bermakna secara statistik, perubahan dari hari ke-1 (baseline) kadar lekosit pada perubahan hari ke-1, 2, dan 3 antara kelompok control dan eksperimen.
Grafik 6 menggambarkan tidak ada perbedaan yang bermakna secara statistik, perubahan dari hari ke-1 (baseline) kadar lekosit pada perubahan hari ke-1, 2, dan 3 antara kelompok control dan eksperimen.
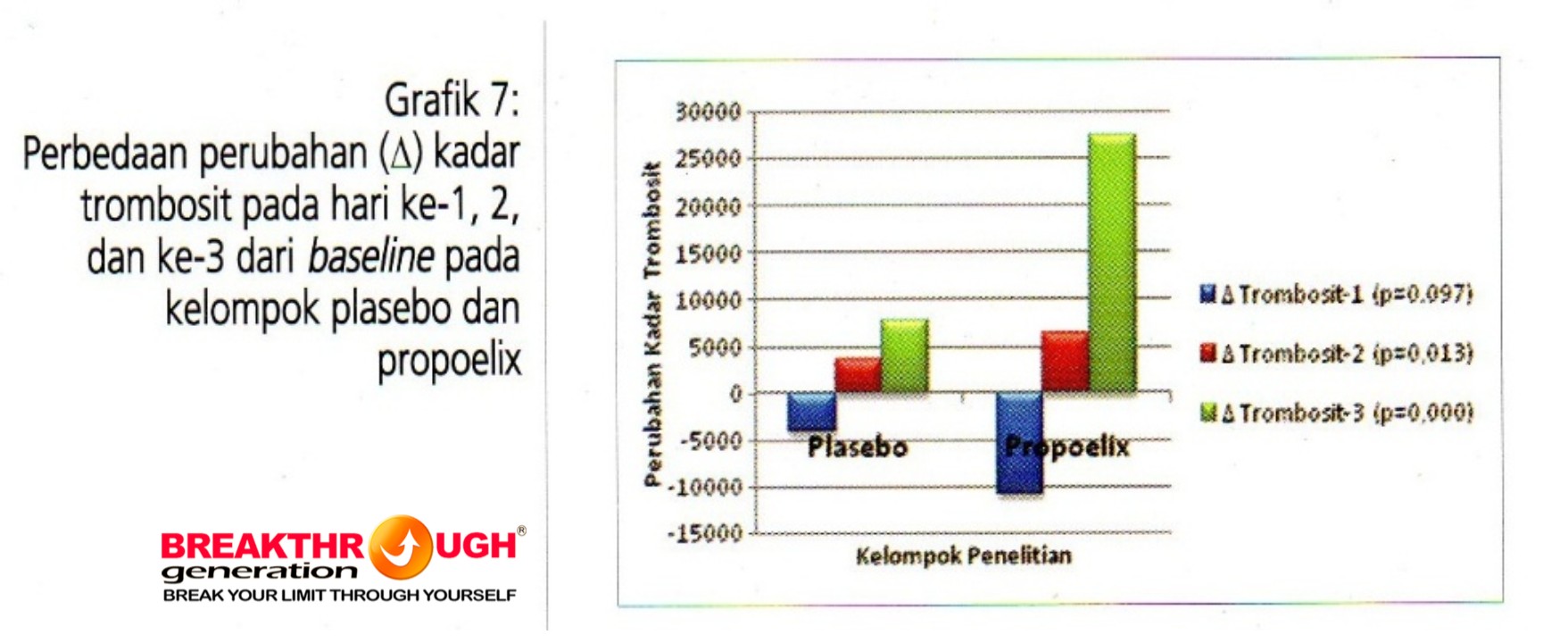 Grafik 7 menggambarkan tidak ada perbedaan yang bermakna perubahan dari hari pertama (baseline) kadar trombosit pada perubahan hari ke-1. Sedangkan perubahan kadar trombosit terjadi pada hari ke-2 (p=0,0013) dan hari ke-3 (p=0,000) terdapat perbedaan bermakna perubahan kadar trombosit antara kelompok placebo dan propoelix. Kelompok propoelix menunjukkanperubahan yang lebih cepat kenaikan kadar trombositnya mulai hari ke-3 dan ke-4 (perubahan trombosit hari ke-2 dan ke-3 pengukuran).
Grafik 7 menggambarkan tidak ada perbedaan yang bermakna perubahan dari hari pertama (baseline) kadar trombosit pada perubahan hari ke-1. Sedangkan perubahan kadar trombosit terjadi pada hari ke-2 (p=0,0013) dan hari ke-3 (p=0,000) terdapat perbedaan bermakna perubahan kadar trombosit antara kelompok placebo dan propoelix. Kelompok propoelix menunjukkanperubahan yang lebih cepat kenaikan kadar trombositnya mulai hari ke-3 dan ke-4 (perubahan trombosit hari ke-2 dan ke-3 pengukuran).
 Grafik 8 menggambarkan adanya perbedaan pada perubahan penurunan suhu. Kelompok propoelix lebih baik dari pada placebo, namun secara statistic tidak terdapat perbedaan yang bermakna perubahan suhu dari baseline pada hari ke-1, 2, dan 3 antara ledua kelompok penelitian p>0,05.
Grafik 8 menggambarkan adanya perbedaan pada perubahan penurunan suhu. Kelompok propoelix lebih baik dari pada placebo, namun secara statistic tidak terdapat perbedaan yang bermakna perubahan suhu dari baseline pada hari ke-1, 2, dan 3 antara ledua kelompok penelitian p>0,05.
DISKUSI
Hemoglobin kedua kelompok menunjukkan tidak ada perbedaan yang bermakna sejak pengamatan hari pertama sampai keempat. Artinya, baik placebo maupun eksperimen tidak ada perbedaan. Hal ini kemungkinan kadar Hb tidak secara langsung dipengaruhi oleh propoelix.
Terdapat penurunan kadar hematokrit yang dimulai sejak hari kedua perawatan pada kedua kelompok yang mengarah ke nilai normal. Pada kedua kelompok terdapat perubahan hematokrit yang bermakna pada pengukuran hari ke-2, di mana kelompok propoelix terjadi penurunan yang signifikan disbanding control. Disimpulkan bahwa kelompok yang mendapat propoelix menurunkan terjadinya hemokonsentrasi lebih cepat dari kelompok control. Peningkatan nilai hemotokrit merupakan manifestasi hemokonsentrasi yang terjadi akibat kebocoran plasma ke ruang ekstravaskular melalui kapiler yang rusak.
Pada penderita DBD biasanya terjadi leucopenia (penurunan jumlah Lekosit) ringan, normal lekosit antara 5-10 ribu. Pada penelitian ini terdapat perbaikan keadaan leucopenia yang terjadi pada kelompok eksperimen terjadi kenaikan dan dipertahankan setelah dalam batas normal, meskipun perubahan lekosit pada kedua kelompok penelitian tidak menunjukkan perbedaan yang bermakana secara statistik.
Tidak terjadi peningkatan jumlah trombosit yang bermakna pada kelompok kontrol sampai perawatan hari keempat. Pada kelompok yang mendapat propolis peningkatan trombosit secara bermakna dimulai pada perawatan hari ketiga dan berlanjut sampai hari keempat. Terdapat perbedaan bermakna pada pengamatan hari ke-4, di mana kadar trombosit pada kelompok propoelix terjadi peningkatan lebih baik dari control. Diperkuat dengan perubahan trombosit yang berbeda bermakna pada hari ke-2 dan ke-3. Perubahan trombosit pada kelompok eksperimen lebih meningkat secara signifikan dibanding placebo.
Salah satu indikasi perawatan pasien DBD adalah kadar trombosit kurang dari 100ribu/µL (nilai normal trombosit antara 150-400 ribu/µL). stelah pengukuran hari ke-3 dan ke-4, kadar trombosit kelompok propoelix masih menunjukkan kecenderungan meningkat yang signifikan dibandingkan placebo.
Penurunan suhu tubuh terjadi lebih cepat pada kelompok yang mendapat propoelix, yang sudah terjadi sejak hari kedua perawatan dan terus berlangsung sampai mendekati normal pada hari keempat. Sampai hari keempat, suhu masih menunjukkan kecenderungan untuk turun. Hal ini diperlukan pengamatan lebih lama lagi untuk melihat sampai suhu berapa menjadi stabil.
Terdapat perbedaan perawatan yang bermakna antara kedua kelompok yang mendapat propoelix dibandingkan kelompok control, di mana kelompok eksperimen lebih singkat hari rawatnya di rumah sakit. Hal ini bermakna bahwa pemberian propoelix mempersingkat perawatan di rumah sakit.
Selama penelitian tidak dijumpai adanya efek samping yang tidak diinginkan pada ketiga kelompok. Tidak di dapati pasien yang mengalami perburukan klinis yang mengarah ke syok atau terjadi Dengue Syok Syndrome (DSS).
Dapat disimpulkan bahwa pemberian propoelix sebagai terapi tambahan atau pendukung pada kasus DBD bermakna dalam memperbaiki kondisi klinis yang ditandai dengan, penurunan hematokrit (pencegahan hemo konsentrasi), perbaikan keadaan leukopeni, peningkatan jumlah trombosit, penurunan suhu tubuh yang lebih cepat, dan berkurangnya lama perawatan di rumah sakit.
Propolis sebagai salah satu dari sedikit penyembuh alami, dalam banyak penelitian telah dibuktikan mempunyai efek antiinflamasi, antibakteri, antifungi, aktivitas imunomodulator, dan antikanker. Dalam penelitian ini, propoelix yang merupakan propolis ekstrak dibuktikan memperbaiki semua parameter klinis, laboratorium, dan lama hari perawatan.
KETERBATASAN PENELITIAN
Pengamatan penelitian hanya dilakukan selama empat hari tampak pada rerata pengukuran trombosit masih ada kecenderungan meningkat, tetapi belum mencapai 100.000. Demikian juga dengan pengamatan suhu tubuh, terjadi penurunan dan masih berlangsung sampai hari keempat belum sampai kondisi yang stabil.
KESIMPULAN
Propoelix yang merupakan ekstrak dari propolis efektif sebagai terapi tambahan pada pasien Demam Berdarah Dengue, karena dapat memperbaiki kondisi klinis (menurunkan suhu lebih cepat), memperbaiki parameter laboratorium (mempercepat kenaikan trombosit, menurunkan hematokrit), dan mempersingkat lama perawatan di rumah sakit.
SARAN
Perlu dilakukan penelitian lebih lanjut mengenai keefektifan propoelix yang merupakan propolis ekstrak sebagai terapi tambahan dengan waktu yang lebih panjang pada DBD dan juga terhadap jenis penyakit yang lain. Perlu pengamatan yang lebih lama lagi untuk mendapatkan gambaran klinis dan laboratorium sampai keadaan stabil dan normal. Perlu pengamatan dengan subjek dan populasi lebih luas di tempat lain sebagai pembanding sehingga hasil penelitian dapat digeneralisasi.
Daftar Pustaka
- Abd El-Hady, F. K. Gas chromatography – mass spectrometry (GC/MS) study of Egyptian propolis-2 – Flavonoid constituents. Egypt. I Appl. Sci. 1994;9(8): 91-109.
- Abd El Hady FK, Hegazi AG. Egyptian propolis: 2. Chemical composition, antiviral and antimicrobial activities of East Nile Delta propolis. Z Naturforsch (C). 2002;57:386-394.
- Alyane M, Roibah H, Lahouel M. Cardioprotective effects and mechanism of action of polyphenols extracted from propolis against doxorubicin toxicity. Pak. J. Pharm. Sci., 2008;21(3):201-209.
- Burdock GA. Review of the biological properties and toxicity of bee propolis (propolis). Food Chem Toxicol. 1998;36:347-363.
- Elaine C.E. Gebara, Luiz A. Lima, Marcia P.A, Mayer. Propolis antimicrobial activity against periodontopathic bacteria. Braz. J. Microbiol. Vol. 33 no. 4 S o Paulo Oct/ Dec. 2002.
- Gatot D. Perubahan Hematologi pada infeksi dengue. Demam Berdarah Dengue. Balai Penerbit FKUI, 1999:44-54.
- Hegazi, A.G. (1997-a): Propolis an overview. International Symposium On Apitherapy, Cairo 8-9th, march, 1997.
- Hegazi ag, Abd El Hady FK. Egyptian propolis: 3. Antioxidant, antimicrobial activities and chemical composition of propolis from reclaimed lands. Z Naturforsch (C). 2002;57:395-402.
- Machmoud L.Biological Activity of Bee Propolis in Health and Disease, Asian Pac J Cancer Prev, 7, 22-31.
- Suharyono W. Diagnosis Laboratorium Infeksi Virus Dengue. Balai Penerbit FKUI, 1999:55-64.
- Sumarmo PS. Masalah Demam Berdarah Dengue di Indonesia. Balai Penerbit FKUI, 1999:1-12.


